实验小技巧 | O2k多维度能量代谢分析系统检测面包酵母活性氧的产生率
背景介绍
面包酵母是一种无水生物,以其在没有水的情况下可以持续数十年而闻名。当再水合时,它可以在几分钟内迅速恢复活跃的新陈代谢。此外,干面包酵母在30至40°C再水合时具有较高的活性 [1,2]。
实验技巧
市售的冻干面包酵母可在磷酸钠缓冲液 (1 mL) 中水化,要获得均匀的细胞悬液,需移液枪吹打混匀20次,持续10分钟。样品加入O2k舱室之前需再次轻轻吹打混匀10次,后将20 µL的样品加入2 mL的舱室 (37°C) 中。由于细胞迅速沉积和聚集,样品在加入两个舱室之间,需再次将细胞悬液吹打混匀10次。
试剂
呼吸介质:MiR05
酵母原液悬浮液(20 mg/mL):
-
将20 mg面包酵母(活性干酵母颗粒)溶解在1 mL温呼吸培养基中[3]。
-
移液枪缓慢吹打混匀20次,获得均匀的细胞悬液。
-
移液枪快速吹打混匀10次,使用加样针将20(100)μL酵母悬液加入每个2ml舱室中(舱室内的最终浓度为0.2(1.0)mg/mL;在本例中使用了1.5 mg/mL)。
-
样品在每次加入舱室前,需将混悬液再次吹打混匀10次。
H2O2 校准溶液(40 µM):
(推荐试剂:Sigma-Aldrich 323381,3 %过氧化氢溶液= 880 mM)
制备步骤如下:
-
H2O2 稀释1 (1:88):将10 µL 3 %过氧化氢溶液加入 870 µL 10 µM HCl溶液中,获得10 mM H2O2溶液。
-
H2O2 稀释2 (1:125):在996 µL 10 µM HCl 溶液中加入4 µL 10 mM H2O2 溶液,得到40 µM H2O2溶液。
Amplex® UltraRed (AmR):
-
储存溶液= 10 mM AmR溶于DMSO。
辣根过氧化物酶 (HRP ):
500 U/mL HRP 溶于MiR05。
-
CCCP (U):1 mM 储备溶液(1.02 mg溶于5 mL DMSO中)。与哺乳动物细胞或线粒体相比,完整酵母需要更高浓度的解偶联剂。
-
FCCP(U): 1 mM 原液,现已被CCCP取代。FCCP 的溶剂乙醇具有刺激酵母呼吸的缺点。DMSO作为CCCP的溶剂可避免这种情况。
O2k的实验设置
温度:37°C
电流 (Amp) 传感器:1000
电流传感器的极化电压:100 mV
数据记录间隔:2秒
试验方案
|
滴定试剂 (最终浓度) |
试剂名称 |
添加量 [µL] |
|
Yeast (0.2 to 1.0 mg/mL)* |
Yeas |
20 to 100 |
|
Amplex® UltraRed (10 µM) |
AmR |
2 |
|
Horse radish peroxidase (1 U/mL) |
HRP |
4 |
|
SOD (5 U/mL) |
SOD |
Variable |
|
H2O2 (0.1 µM steps, total 0.2 µM) |
H2O2 |
5 + 5 (two steps) |
|
Glucose (20 mM) |
Glc (2 M stock) |
20 |
|
EtOH |
EtOH (pure) |
40 |
|
CCCP (5 µM steps)** |
U |
10+10+10+ 10+.. |
*可通过注入纯氧气进行氧气补充。
结果与讨论
在图 1 所示的研究中,在缺氧和高氧条件下以及葡萄糖刺激呼吸后研究了酵母(1.5 mg/mL)的呼吸以及H2O2的产生。其呼吸的氧动力学(图 1B)与分离的线粒体非常相似但不完全相似[4],这表明细胞外的氧气水平提供了近似细胞内的条件。细胞外底物葡萄糖和乙醇以及解偶联剂的滴定可显著刺激呼吸(图 2)。相反,这些底物对细胞外H2O2的产生影响很小(图 2)。
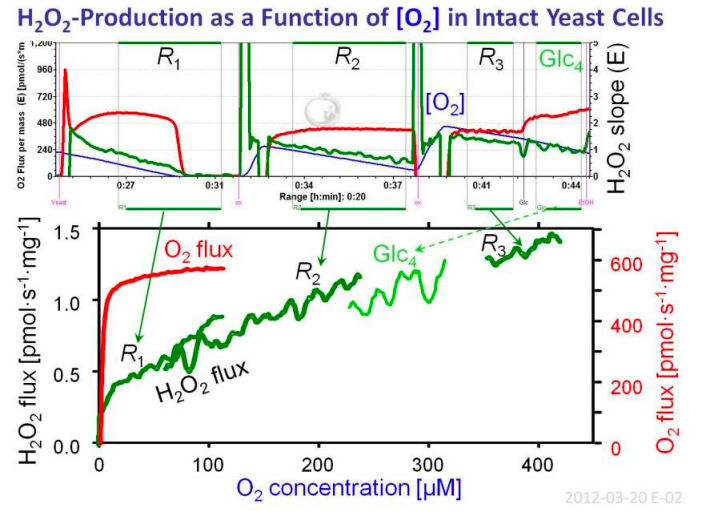
图 1、氧浓度(蓝线)、耗氧率(红线)和过氧化氢产量(绿线)随时间和氧气浓度变化的O2k曲线。细胞外H2O2的产生是高压氧和常氧范围内氧气浓度的线性函数[5]。
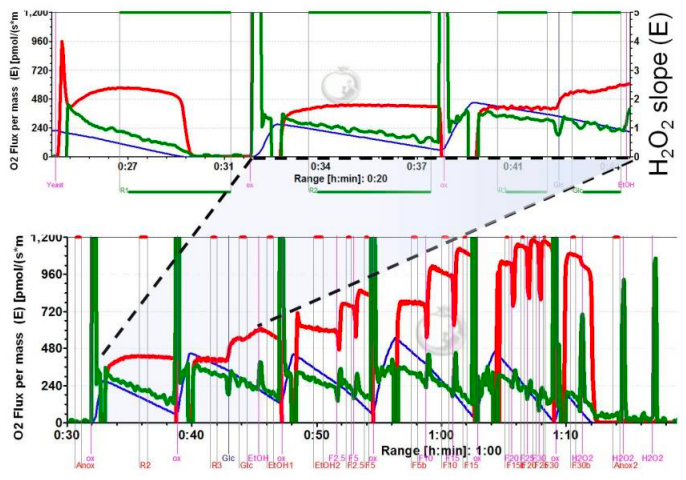
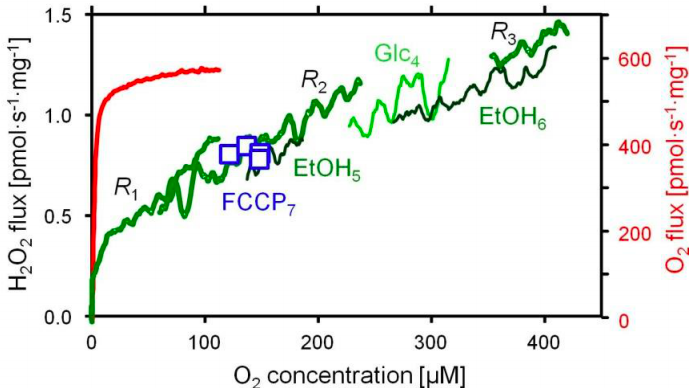
图 2、 图 1中所示实验的扩展,通过乙醇刺激呼吸和通过FCCP滴定解偶联。在没有外部底物 (R1-R3)、葡萄糖 (Glc4)、乙醇 (EtOH5和EtOH6) 和解偶联后 (FCCP7) 的不同代谢状态下的细胞外过氧化氢产生的氧依赖性。
参考文献
1. Crowe HJ, Carpenter FJ, Crowe M (1998) The role of vitrification in anhydrobiosis. Annu Rev Physiol 60:73-103.
2. Koga S, Echigo A, Nunomura K (1966) Physical properties of cell water in partially dried Saccharomyces cerevisiae. Biophys J 6:665-74.
3. Komlodi T, Sobotka O, Krumschnabel G, Bezuidenhout N, Hiller E, Doerrier C, Gnaiger E (2018) Comparison of mitochondrial incubation media for measurement of respiration and hydrogen peroxide production.Methods Mol Biol 1782:137-55. - »Bioblast link«
4. Scandurra FM, Gnaiger E (2010) Cell respiration under hypoxia: Facts and artefacts in mitochondrial oxygen kinetics. Adv Exp Med Biol 662:7-25. - »Bioblast link«
5. Boveris A, Chance B (1973) The mitochondrial generation of hydrogen peroxide. General properties and effect of hyperbaric oxygen. Biochem J 134:707-16. - »Bioblast link«



